從創新醫材產品roadmap淺談醫療器材產業產品開發挑戰
原文最早發表於Linkedin post.
日前拜讀2020行政院生技產業策略諮議委員會之以精準健康翻轉產業創新議題
茲摘錄安克生醫李副董之簡報,如附圖
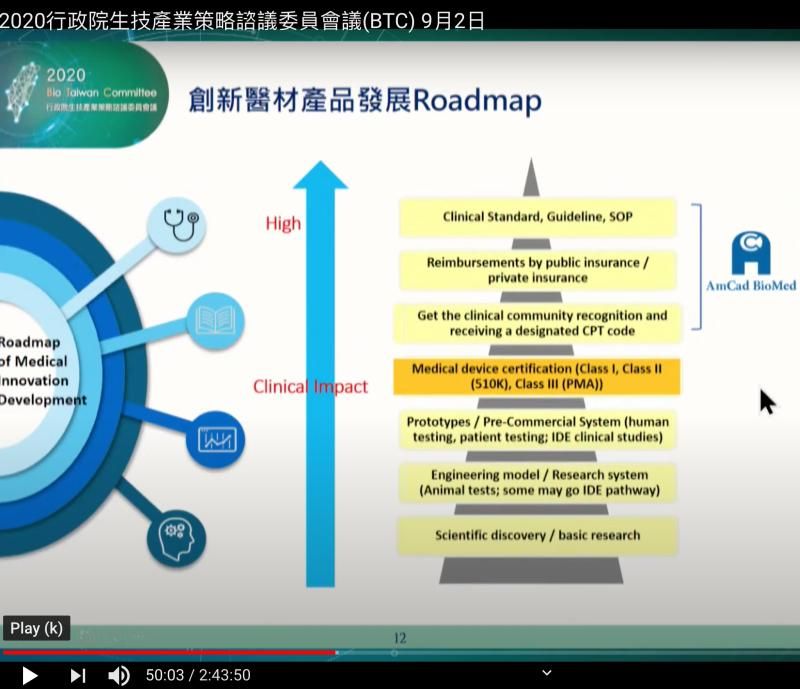
其提到創新醫材產品roadmap,個人認為除了是個很好的參考外,也可部分用到其他醫材
就個人看過的許多案例,很多公司到橘色的部分( medical device certification)就過不了關,不然 就是拿到了CE,但FDA可能遙遙無期
常見的原因有(1)技術力不足,實驗數據基本是一番兩瞪眼 ,或是產品根本無法產出(2)法規基礎不夠紮實,整個design control流程在design input沒有完整考量安規,風險,usability, performance需求,(3)產品開發資訊沒有統合,資訊製作技資時左支右絀,資訊互相矛盾,或是無法相互連結,審查員的一個問題衍生出更多問題等等
之前所提到法規基本概念(如確認intended use),風險管理,Usability, design control, Product management等, 大多是探討用系統手法解決這類的問題,其中而個人之前強調的Product Management機制,攸關資訊統合的程度
過了認證這關,更大的挑戰才開始
(1)認證其實只是法規的最基本上市要求,規格,性能不夠好,也是阻礙重重
(2)醫材其實是一個光譜寬廣的產業,高階高價,低階低價在這光譜皆有其位置,但C/P有問題,如低階高成本,個人目前從未看出其有任何出路
(3)以上只是用在既有的成熟產品,若是創新產品會遇到該簡報上提到的健保給付,何時被納入臨床指引(Guideline)等挑戰
尤其是第3點,現在醫學要求實證,所以需一連串的臨床研究,橫跨各洲,實驗需要各地區的key opnion leader (KOL)領導,而後在各區的醫學學會發表,這類的工作,除了巨大的資金需求外,還要紮實的產品管理/法規/臨床團隊在背後支援
不過,該演講提到,台灣的醫材業遇到優秀人才都被Google等公司挖走,個人之前聽過醫工的教授的感嘆,好的人才都到電子業
但個人的了解,不少優秀的醫工人才心中都有一個讓他們加入醫工的理念,這不是用待遇就能打動的,而是一個環境讓他們可以奮鬥
相對之前的半導體,面板等需要巨額設備的投資,以上所要的資金算是微不足道,但可以為每家醫材公司樹立一個很難跨越的門檻,台灣要是這類公司四處林立,就好像一個基金有各種組合,抗風險能力更強
